一、体内各种主要脏器对无氧缺血的耐受力
正常体温时,心肌和肾小管细胞的不可逆的无氧缺血损伤阈值约30min。肝细胞可支持无氧缺血状态约1~2h。肺组织由于氧可以从肺泡弥散至肺循环血液中,所以肺能维持较长一些时间的代谢。
脑组织各部分的无氧缺血耐受力不同,大脑为4~6min,小脑0~15min,延髓20-30min,脊髓45min,交感神经节60min。
促使细胞发生不可逆的死亡机制,目前还只是些概念和假说,尚未形成一整套的理论。
二、无氧缺血时细胞损伤的进程
心脏骤停后,循环停止,如立即采取抢救措施,使组织灌流量能维持在正常血供的25%~30%。大多数组织细胞和器官,包括神经细胞均能通过低氧葡萄糖分解,获得最低需要量的三磷酸腺甙(ATP)。心脏搏动的恢复性很大,脑功能也不会受到永久性损伤。如血供量只达15%~25%之间,组织细胞的葡萄糖供应受到限制,氧亦缺乏,ATP的合成受到严重影响,含量降低。如心脏搏动未恢复,组织灌流量亦未能增加,ATP就会耗竭,正常细胞的内在环境稳定性即被严重破坏。此时如再加大组织灌流,反而会促使组织细胞的损伤达到不可逆的程度,即所谓“再灌流所致的损伤”。
如组织灌流量在心脏骤停后,只维持在正常血供的10%以下,即所谓的“涓细血流”,ATP迅速耗竭,合成和分解代谢全部停顿,称为“缺血性冻结”。此时蛋白质和细胞膜变性,线粒体和细胞核破裂,胞浆空泡化,最后溶酶体大量释出,细胞发生坏死。这是一幅细胞不可逆变化的景象。
70年代末,Hearse和Nayler等提出缺血性心肌在某种条件,再灌流反而损坏了有可能恢复的心肌细胞。这被认为是再灌流损伤造成的细胞死亡,应该与缺血所致细胞死亡的概念区分开来。心脏骤停后,组织灌流立即停止,并不立即死亡。前面已提到,不同组织细胞的无氧缺血耐受阈值不同。那么究竟是心肌细胞本身由于长时间缺氧缺血,已经发生了严重损伤,而再灌流带来了多种有害物质,于是加速细胞死亡;抑或再灌流所带来的有害物质,如大量的钙离子、氧游离基、双价铁游离子等等。使本有可能恢复的缺氧缺血细胞完全失去恢复的能力。这似乎是一个矛盾现象:心脏骤停,组织灌流停,必须使之立即恢复,重新给细胞带来所需的氧,恢复合成ATP,提供能量,使细胞恢复功能。组织细胞如在无氧缺血耐受时限内,能获得正常血供的25%~30%,就有希望使复苏成功。或使用钙离子通道阻滞剂、氧游离基清除剂、铁离子螯合剂于再灌流的血液中,有的学者已在实验动物中取得防止再灌流损伤的作用。这是当前复苏学的一项重点研究课题。
三、钙离子在无氧缺血时细胞损伤中的作用
正常情况下,细胞外和细胞内的Ca2+梯级差为10000:1。它的两个主要作用是:
(一)延缓房室交界区的传导和延长该区细胞的不应期 这可使左、右束支和心室肌纤维恢复极化,使下传的脉冲可以顺利地进行心室肌细胞除极,不致因遇到尚处于不应期的束支而影响传导;同时因为在交界区的延缓,就有足够时间让心室充盈得较满意。
(二)形成电和机械耦联 结合肌动蛋白和肌凝蛋白,心肌和血管平滑肌方能收缩。
钙离子进入细胞后,促发细胞内储存库(肌浆网)释出储存的Ca2+(图6-1)。两者的总量足够提供细胞蛋白质收缩所需。多余的Ca2+由ATP泵出细胞外。如ATP合成受阻,不能泵出多余Ca2+至细胞外;同时由于细胞膜因无氧性缺血的影响,Ca2+同慢通道离子变成快通道离子,大量进入细胞内。细胞内的Ca2+浓度可以从0.1μmol的基数增高到接近细胞外的浓度1.0mmol。
细胞内增多的Ca2+储存在线粒体内。Ca2+激活磷酯A2(一种破坏细胞膜完整性的酶)。细胞膜被破坏后,释出花生四烯酸,是一种游离脂肪酸。再灌流时提供的氧,在环氧化酶催化下,生成大量血栓素(图6-2),是强力的可使心肌纤维和血管壁平滑肌纤维挛缩物质,此外血栓素并破坏线粒体的膜。ATP主要在线粒体内合成,线粒体被破坏后,ATP不能合成,体内的能量就更易耗竭,到了不可逆的阶段。
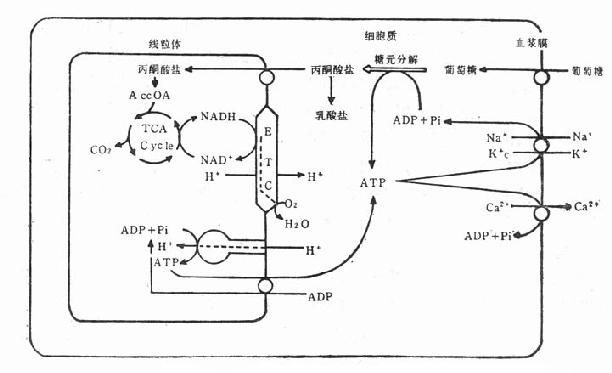
图6-1钙离子在心肌收缩的作用
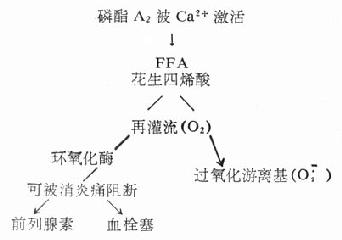
图6-2 Ca2+激活磷酯A2示意图
磷酯A2被激活后,释放出游离脂肪酸(FFA),细胞质中花生四烯酸
含量增高。超过组织器官无氧缺血的耐受阈值之后,组织
再灌流时,即产生一系列有害过程。
(引自Ann Emerg Med 12:471,1983)
四、氧游离基在组织无氧缺血时的破坏作用
氧是代谢作用必不可缺的因素。正常时,它在组织系统中经细胞内的色素系统作用,进行4价还原。在还原时,有1%~2%的氧分子逸出,进行单价还原,它具有高度反应作用的活性。因为单价还原的氧分子最外圈只含有一个离子,成为氧游离基,包括过氧化游离基(O![]() )和氢氧游离基(
)和氢氧游离基(![]() )均属极强的氧化或(和)还原物质。如果过多地存在,就会威胁细胞的完整性。正常时,由过氧歧化酶(superoxide dismutases,SODs)阻止这些游离基的过强作用。无氧缺血时,氧游离基含量在细胞内大量增加,超过氧歧化酶的清除作用,严重地破坏蛋白质和脂肪的成分,引起了广泛的脂肪过氧化酶的连锁反应,从而严重地破坏了细胞的正常结构。
)均属极强的氧化或(和)还原物质。如果过多地存在,就会威胁细胞的完整性。正常时,由过氧歧化酶(superoxide dismutases,SODs)阻止这些游离基的过强作用。无氧缺血时,氧游离基含量在细胞内大量增加,超过氧歧化酶的清除作用,严重地破坏蛋白质和脂肪的成分,引起了广泛的脂肪过氧化酶的连锁反应,从而严重地破坏了细胞的正常结构。
五、铁离子在组织无氧缺血时的破坏作用
上面提到缺血组织中,过氧化游离基含量过多,通过它的促发作用,引起铁离子催化的Haber-Weiss反应,产生反应力极强的氢氧基。
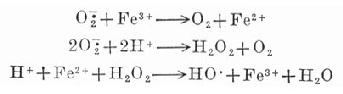
线粒体中细胞色素,铁蛋白(Ferritin)以及其他含铁酶可以释放足够的游离的离子铁进行催化作用。结果摧毁了细胞膜。而铁螯合剂——去铁胺(deferoxamine)可以起到保护作用。在实验动物中,证实用去铁胺(50mg/kg体重,静脉注射)于心脏骤停(用注射冷1%氯化钾使之骤停)的大鼠进行复苏时5min内使用,可以获得100%的存活率。
六、脑复苏的重要性
近来对於心脏骤停后,神经系统受损的严重性和正确的治疗方法已越来越引起临床家的关注。一项临床统计值得重视:经“复苏存活”而住院的病人,最终死亡,其中由于明显的神经系统损伤者占59%,因严重心力衰竭者占31%。这些病人的组织损伤可以认为都是在再灌流以后加重的。有的学者称之为“复苏后综合征”,大致可以分为三期:
(一)充血期 这是最初很短暂的时期,灌流可以超过正常时期,但是分布不均匀。目前尚不清楚这些增加了的血流是否确切灌注了微循环。
(二)低灌流期(或称“无再灌流期”) 经过充血15~30min后,开始发生细胞水肿,同时出现血凝块,红细胞凝集,血流成泥流状,血小板聚集。此外,还可能存在颅压增高、脑血管收缩、毛细血管周围红细胞肿胀等。最终发生脑血管痉挛,此时脑血流显著淤滞。这一低灌流现象在脑组织各部的严重程度并不一致,一般可持续18~24h。现在已经引起了临床家和研究人员的严重关注,试图改善这些异常现象,即在生命抢救方案中,增加适当防护措施,或在复苏术取得初步成功后,对这类病人加以特殊的强化监护治疗。但是到目前为止,还没有肯定的有效治疗方法。
(三)后期 低灌流期以后,经过救治,脑组织可能部分恢复功能,并逐渐完全恢复(这与抢救时机及所采取的措施有密切关系);或持续性低灌流,导致长时间或永久性昏迷;或发展至脑死亡。
脑复苏后综合征全过程中的病理生理变化到目前为止和其他脏器在复苏过程中的病理生理变化一样,所取得的都是零碎的、片断的资料,还缺乏对它们的充分认识,亦尚未形成成套完整的理论体系。很多未知数尚待深入研究以求得明确的答案。有些情况是明了的。脑组织在人体器官中是最易受缺血伤害的。这是由于它的高代谢率、高氧耗量和对高血流量的要求。整个脑组织重量只占体重的2%,但静息时,它要求的氧占人体总摄取量的20%,要求的血流占心排出量的15%。心脏骤停后引起的无氧性缺血,脑组织中的ATP含量即减少90%。因此心搏停止后最早出现的症状之一是深昏迷。基础生命抢救的主要目的亦即提供脑组织最低的血流量。
虽经实验发现,心脏骤停后直至血供降至正常的30%~35%以下,大脑的神经元突触的传导功能都可以维持。如果降至20%以下,神经元的的生存力就受到损坏。但另有报道,如果大脑血供能维持在15%正常血供以上,并接受经过处理的再灌流血液:加入Ca2+通道阻滞剂、Fe2+螯合剂和清除氧游离剂的SODs、抗坏血酸、维生素E等,是有可能恢复脑组织功能的,但是至今还都是实验室的结果,还没有肯定的临床实践报道。